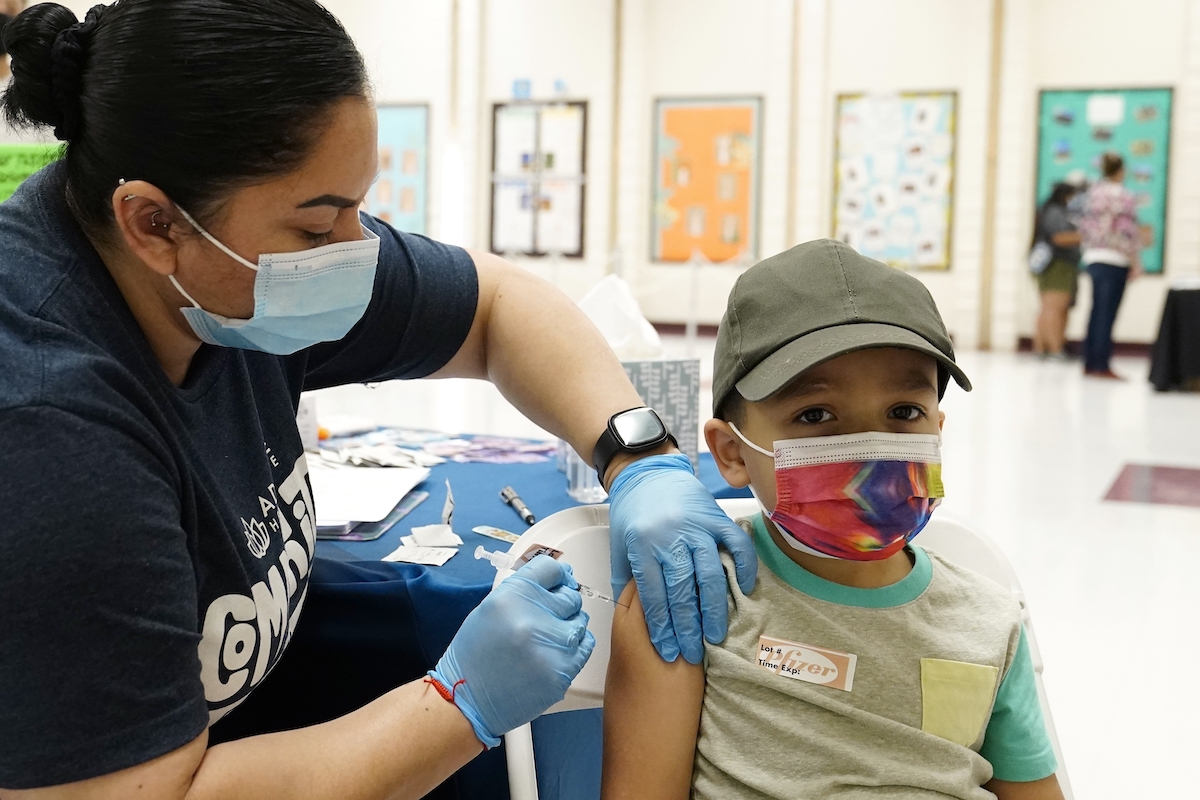
(中央社華盛頓11日綜合外電報導)美國食品暨藥物管理局(FDA)認為,讓6個月到4歲幼兒接種輝瑞大藥廠和德國生技公司BioNTech的COVID-19疫苗仍需更多數據,因此將推遲至少2個月才會做出決定。
路透社報導,美國政府打算於本月21日開放這個年齡層的幼兒接種COVID-19(2019冠狀病毒疾病)疫苗,因此食藥局原本計劃依據早期試驗數據,最快在下週做出決定。
食藥局今天表示,在輝瑞(Pfizer)和BNT申請緊急使用授權後,已檢視新收到的試驗資料,決定需要更多數據才能權衡是否批准。
食藥局表示,全美約有1800萬名孩童落在這個年齡層,急著替孩子接種的家長可以放心,食藥局正在花時間確認這支疫苗符合許可標準。
食藥局生物製劑評估暨研究中心(Center for Biologics Evaluation and Research)主任馬克斯(Peter Marks)說:「如果未達標準,程序就不能繼續進行。」他提到,促使食藥局推遲決定的部份新數據才剛出爐。
輝瑞和BNT本月稍早曾應食藥局要求,提交3劑接種計畫中的前2劑數據;食藥局並未公布有關效力的資料。
輝瑞和BNT提交數據一事令人訝異,因為這兩家公司去年12月表示,2劑低劑量疫苗的早期試驗結果未能達到預期,還修改了臨床試驗來測試3劑的版本。
輝瑞及BNT今天表示,預期在4月初可得出3劑疫苗計畫的數據。(譯者:李佩珊/核稿:曾依璇)1110212
我是廣告 請繼續往下閱讀
食藥局今天表示,在輝瑞(Pfizer)和BNT申請緊急使用授權後,已檢視新收到的試驗資料,決定需要更多數據才能權衡是否批准。
食藥局表示,全美約有1800萬名孩童落在這個年齡層,急著替孩子接種的家長可以放心,食藥局正在花時間確認這支疫苗符合許可標準。
食藥局生物製劑評估暨研究中心(Center for Biologics Evaluation and Research)主任馬克斯(Peter Marks)說:「如果未達標準,程序就不能繼續進行。」他提到,促使食藥局推遲決定的部份新數據才剛出爐。
輝瑞和BNT本月稍早曾應食藥局要求,提交3劑接種計畫中的前2劑數據;食藥局並未公布有關效力的資料。
輝瑞和BNT提交數據一事令人訝異,因為這兩家公司去年12月表示,2劑低劑量疫苗的早期試驗結果未能達到預期,還修改了臨床試驗來測試3劑的版本。
輝瑞及BNT今天表示,預期在4月初可得出3劑疫苗計畫的數據。(譯者:李佩珊/核稿:曾依璇)1110212