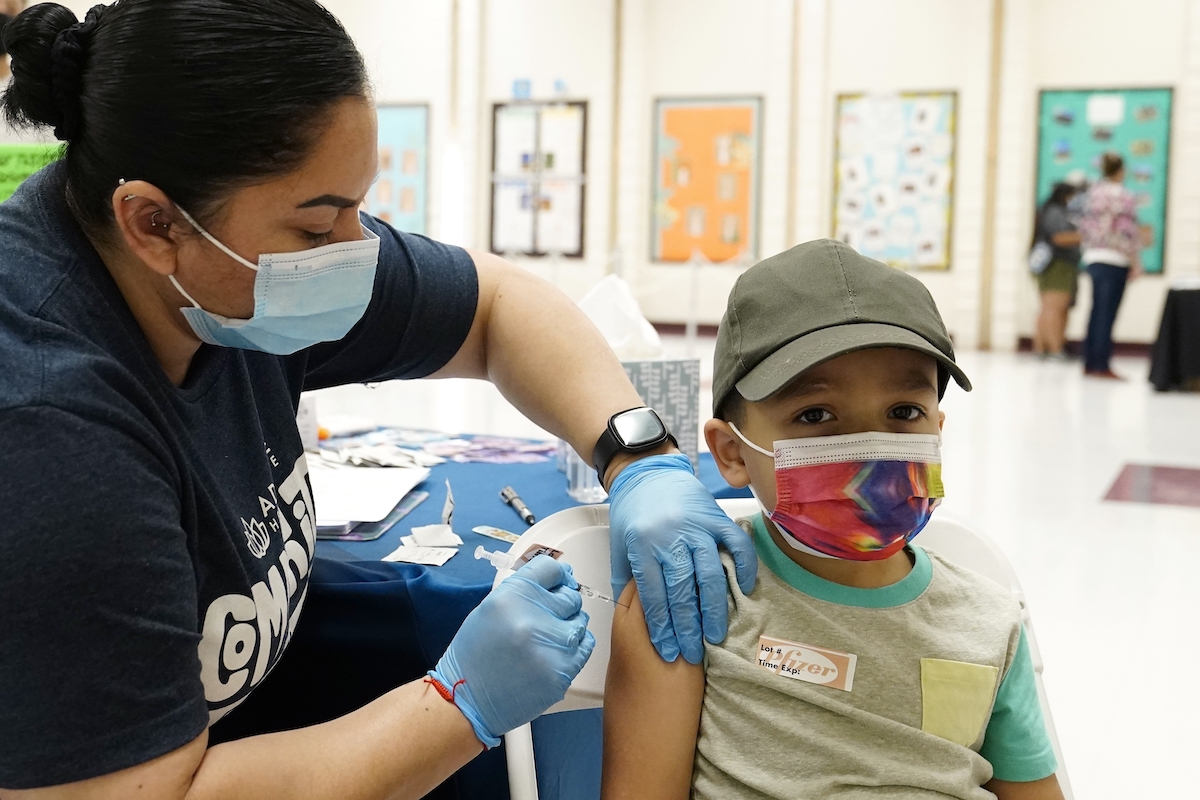
(中央社記者徐薇婷華盛頓1日專電)美國確診天天破6位數,為讓6個月大至未滿5歲幼童盡快獲得疫苗保護,華郵報導,美國藥廠輝瑞(Pfizer)和德國生技公司BioNTech計劃今天向美國衛生機關申請緊急授權,最快可望2月底通過。
「華盛頓郵報」(The Washington Post)昨天引述知情人士指出,輝瑞與BioNTech(簡稱BNT)藥廠預計最快1日向美國食品暨藥物管理局(FDA)提出緊急使用授權(EUA)申請,讓6個月大至未滿5歲幼童也能接種COVID-19(2019冠狀病毒疾病)疫苗。
美國衛生當局去年10月核准5歲至11歲孩童接種BNT疫苗,兩劑須間隔3週,施打劑量為10微克,是成人劑量的1/3。
報導表示,輝瑞與BNT去年12月透露,他們針對6個月大至未滿5歲幼童進行的COVID-19疫苗試驗數據不如預期,未在所有年齡層幼童體內引發強健免疫反應。但為加快核准速度,美國FDA仍敦促他們提出EUA申請,讓專家能開始審核程序。
根據試驗結果,施打兩劑3微克BNT疫苗後,6個月大至未滿2歲孩童體內雖產生具保護力的免疫反應,卻未在2至4歲幼童體內引發與青少年、成人相當程度的免疫反應。輝瑞與BNT隨後加入第3劑試驗,但數據最快3月下旬才會出爐。
華郵引述其中一名知情人士說:「我們知道兩劑不夠,這我們明白。我們的想法是先往下走,開始審核兩劑數據;如果數據在提交程序中站住腳,會比等第3劑數據出來才動作讓孩童早上幾個月打完疫苗。」(編輯:楊昭彥)1110202
我是廣告 請繼續往下閱讀
美國衛生當局去年10月核准5歲至11歲孩童接種BNT疫苗,兩劑須間隔3週,施打劑量為10微克,是成人劑量的1/3。
報導表示,輝瑞與BNT去年12月透露,他們針對6個月大至未滿5歲幼童進行的COVID-19疫苗試驗數據不如預期,未在所有年齡層幼童體內引發強健免疫反應。但為加快核准速度,美國FDA仍敦促他們提出EUA申請,讓專家能開始審核程序。
根據試驗結果,施打兩劑3微克BNT疫苗後,6個月大至未滿2歲孩童體內雖產生具保護力的免疫反應,卻未在2至4歲幼童體內引發與青少年、成人相當程度的免疫反應。輝瑞與BNT隨後加入第3劑試驗,但數據最快3月下旬才會出爐。
華郵引述其中一名知情人士說:「我們知道兩劑不夠,這我們明白。我們的想法是先往下走,開始審核兩劑數據;如果數據在提交程序中站住腳,會比等第3劑數據出來才動作讓孩童早上幾個月打完疫苗。」(編輯:楊昭彥)1110202