國產高端疫苗在緊急授權(EUA)前即量產引發爭議,外界質疑有法規、程序問題,指揮中心指揮官陳時中今(2)日也主動於記者會上說明,國產疫苗的生產因為要和疫情賽跑,因此去年就成立了專案輔導諮詢團隊,從製程、臨床研究、法規,甚至還駐場監製,每周進度都要回報,如果等到EUA過了才生產,起碼還要等半年才能施打。
陳時中指出,沒有EUA時的一般製造流程是在研發、臨床都通過後,作查驗登記,大家才會開始量產,之後再經過檢驗封緘就可以上市,但EUA為了加速進行,各國採用很多方法,在符合科學性的前提下,把行政流程簡化。
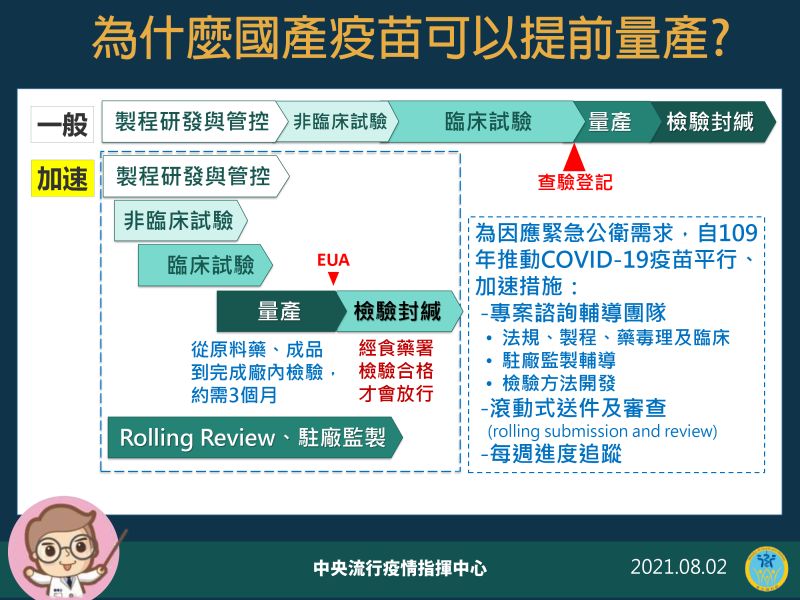
▲中央流行疫情指揮中心2日說明為什麼國產疫苗可以提前量產。(圖/指揮中心)
不過,陳時中強調,就算是加速進行,所有階段的標準都要通過,疫苗才可以上市,「我們都會要求他(廠商)先做,先把一些產品開始做出來,之所以需要EUA就是為了因應公衛緊急事件,要求要快。」若是按照以往的標準程序,查驗登記過了才開始量產,上市時間還會拖延3、4個月,甚至半年不等,對於緊急狀況就會失去效益。
※【NOWnews 今日新聞】提醒您:
因應新冠肺炎疫情,疾管署持續加強疫情監測與邊境管制措施,國外入境後如有發燒、咳嗽等不適症狀,請撥打「1922」專線,或「0800-001922」,並依指示配戴口罩儘速就醫,同時主動告知醫師旅遊史及接觸史,以利及時診斷及通報。
我是廣告 請繼續往下閱讀

不過,陳時中強調,就算是加速進行,所有階段的標準都要通過,疫苗才可以上市,「我們都會要求他(廠商)先做,先把一些產品開始做出來,之所以需要EUA就是為了因應公衛緊急事件,要求要快。」若是按照以往的標準程序,查驗登記過了才開始量產,上市時間還會拖延3、4個月,甚至半年不等,對於緊急狀況就會失去效益。
※【NOWnews 今日新聞】提醒您:
因應新冠肺炎疫情,疾管署持續加強疫情監測與邊境管制措施,國外入境後如有發燒、咳嗽等不適症狀,請撥打「1922」專線,或「0800-001922」,並依指示配戴口罩儘速就醫,同時主動告知醫師旅遊史及接觸史,以利及時診斷及通報。