本土疫情延燒,台灣面臨疫苗短缺問題,讓各界吵的不可開交;同時,國產疫苗的把關標準也備受爭議,沒進行第三期臨床試驗,也不合乎通過緊急授權(EUA)的條件,對此,疾管署人體研究倫理審查會委員劉宏恩早在去年十月就點出問題,「這並不是比照美國FDA的EUA標準,台灣對於國內藥廠的要求標準,比美國來得寬鬆,不只安全性問題,花了經費預算施打疫苗,也必須能夠有效」。
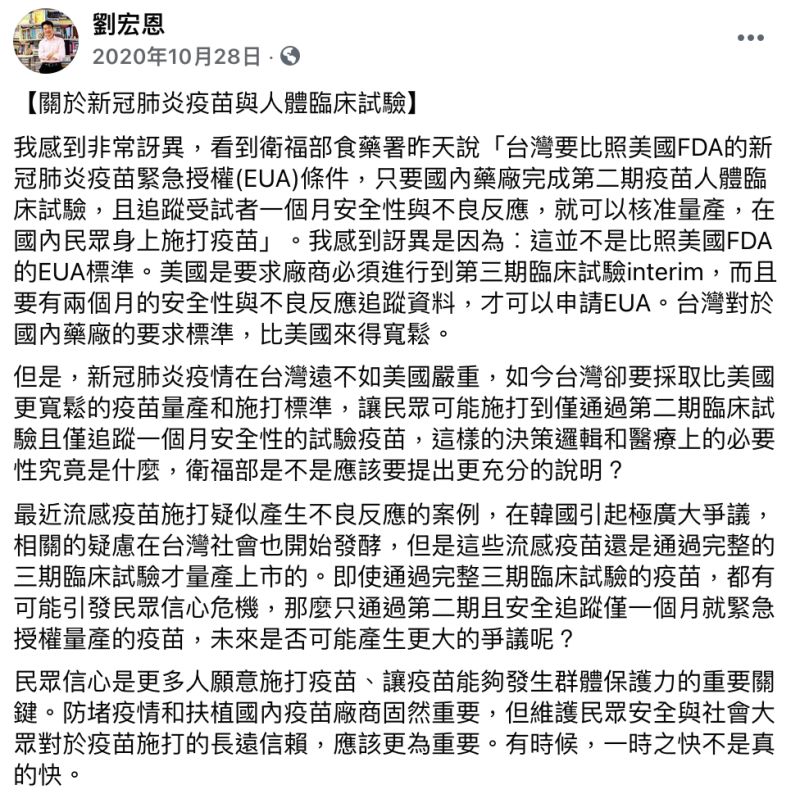
劉宏恩去年10月就在臉書發文,表示衛福部說,台灣要比照美國FDA的新冠肺炎疫苗緊急授權(EUA)條件,只要國內藥廠完成第二期人體試驗,且追蹤受試者一個月安全性與不良反應,就可以核准量產,在國內民眾身上施打疫苗,他對此感到相當訝異「這並不是比照美國FDA的EUA標準」,因為美國是要求廠商必須進行到第三期臨床試驗,且追蹤受試者兩個月,才可以申請EUA,「台灣對於國內藥廠的要求標準,比美國來得寬鬆」。
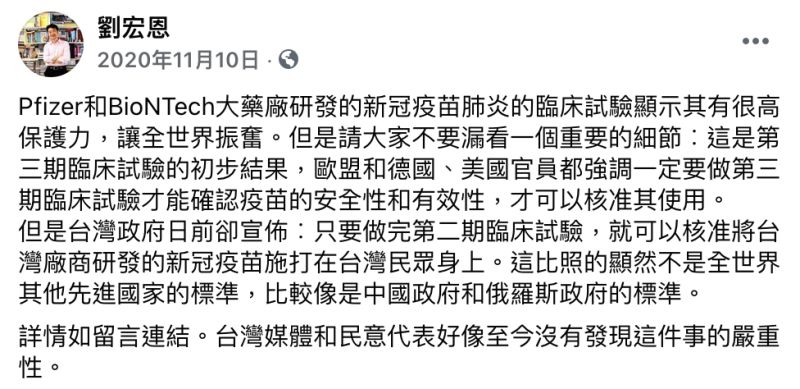
接著,劉宏恩在去年11月再度發文,表示Pfizer和BioNTech大藥廠研發的疫苗臨床試驗顯示其有很高保護力,消息一出全球振奮,「但請不要漏看一個重要的細節︰這是第三期臨床試驗的初步結果,歐盟和德國、美國官員都強調一定要做第三期臨床試驗才能確認疫苗的安全性和有效性,才可以核准其使用」。
他直言,但台灣政府卻宣布「只要做完第二期臨床試驗,就可以核准將台灣廠商研發的新冠疫苗施打在台灣民眾身上」,讓他不解「這比照的顯然不是全世界其他先進國家的標準,比較像是中國政府和俄羅斯政府的標準」。
而《NOWnews今日新聞》日前也報導「還在取笑別牌疫苗差?專家質疑:國產疫苗『可能是問號』」,劉宏恩日前也再度表示「國產疫苗就算號稱解盲成功,由於推測保護力的性能係數標準不明,它們的保護力可能是百分之『?』──對,是個問號」。
事實上,自今年5月本土疫情爆發後,總統蔡英文就預告國產疫苗將於7月上市,但二期臨床試驗都還尚未完成,也引起民眾質疑,認為自己變成「三期試驗的白老鼠」,也使高端疫苗股價連日下跌。因此,今(10)日下午即將召開的高端疫苗二期臨床實驗解盲記者會,各界也都相當關注,希望政府能給個答案。(編輯:郭佩蓉)
※【NOWnews 今日新聞】提醒您:
因應新冠肺炎疫情,疾管署持續加強疫情監測與邊境管制措施,國外入境後如有發燒、咳嗽等不適症狀,請撥打「1922」專線,或「0800-001922」,並依指示配戴口罩儘速就醫,同時主動告知醫師旅遊史及接觸史,以利及時診斷及通報。