疫苗是否安全有效,經過了哪些驗證,國際上靠的是事實和科學,台灣卻似乎自己的玩法,靠的是帶風向和信仰。
面對本土疫情,台灣的「疫苗接種率」和「已購得疫苗劑數」偏低,是不爭的事實,接下來的關鍵問題是,如何靠「國外採購」和「國內生產」來補足缺口?
然而,這些明明應該被好好回答的問題,卻被「政府只說一半,側翼暴衝過頭,國共趁火打劫」所引發的各種爭議所淹沒了。
讓我們就事論事,一起用基礎事實找尋解答。
首先要了解的是,正常時期的疫苗開發,需要經過三期臨床試驗,花費數年來驗證疫苗的「安全性」和「有效性」。然而,COVID-19大爆發是非常時期,急需疫苗救命,所以會改採「緊急使用授權」(Emergency Use Authorization,簡稱EUA),儘速讓疫苗能進行施打。
然而,再怎麼趕時間,EUA還是要確實把關,才不會讓大家打到不夠安全有效的疫苗,因此如何取得EUA,在國際上也有一致標準。以美國食品藥物管理局(FDA)為例,取得EUA的條件是:
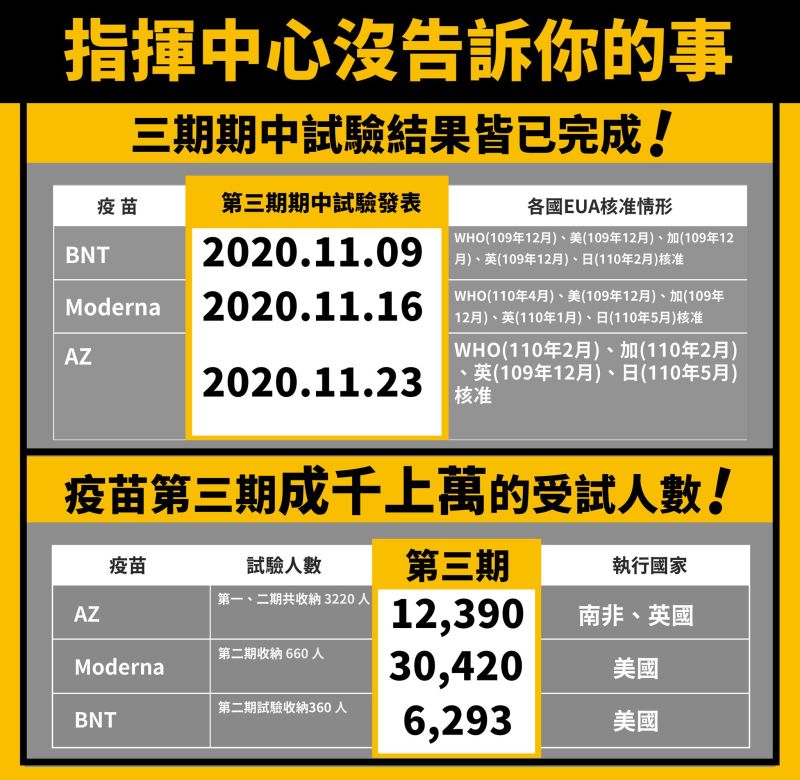
1.已進入第三期試驗,並以期中報告數據為基礎;
2.第三期要有3千名以上的受試者;
3.第三期至少一半的受試者,要有至少2個月的追蹤數據。
我們最常聽到的牛津AZ(AstraZeneca)、莫德納(Moderna)及輝瑞BNT(Pfizer-BioNTech)等疫苗,全部都是符合上述條件後才取得EUA,再獲各國採購而投入施打。
基礎事實釐清後,我們回頭看最近幾種說法的問題出在哪,就會很清楚了。
第一,國外疫苗都只做到二期,台灣的國產疫苗目前也是做到二期,當然沒問題?
這種說法有很大的誤導性。
指揮中心曾拿出一張表,秀出國際疫苗做二期的人數,但這話其實只說了一半。
事實是,這些疫苗都是「二期已完成」,「三期試驗已開始進行且有成千上萬的跨國受試者」,「已提出第三期的期中報告」,供各國政府審核疫苗安全性和有效性,才取得EUA。
然而,台灣目前兩支國產疫苗都是處於「尚未提出二期報告」,「尚未進入第三期試驗」,「更別提第三期期中報告」。三個要件比一比,狀況完全不一樣,根本無法斷章取義地硬解釋成「大家都沒做完第三期,所以都施打,反而只凸顯了國產疫苗的安全性和有效性「仍待驗證」。
一種衍生的說法是,已有世界衛生組織(WHO)的專家建議,EUA未必非得進入第三期試驗,所以台灣也不用。這個建議確實存在,但仍在爭論中。國產疫苗如果要跟國際接軌,目前要符合的依舊是現有的EUA標準。
另一種衍生的說法是「國產疫苗第二期的受試者很多,所以沒問題」,但第二期和第三期試驗內容並不等同,就好像參加鐵人三項,不能說因為前面游泳和自行車都很名列前茅,所以長跑根本還沒跑,就自動宣布獲勝一樣。
更何況,國產第二期的結果到底成績如何,其實還是未知數,這也是接下來要回答的問題。
第二,所以國產疫苗到底有沒有效?
答案是,在報告出來前,目前所有說法都是沒有根據的。
兩家國產疫苗,都是預計6月多才會公布二期報告。換句話說,現在流傳的各種說法,無論是吹捧還是唱衰,都缺乏科學證據的支持。
例如,有報導宣稱,前副總統陳建仁擔任了第二期的受試者,表態覺得疫苗很好很安全。但這種帶風向的報導,不僅缺乏根據,更可能害到台灣實驗的公信力。
原因是,疫苗研發多是採雙盲試驗(Double-Blind Studies),也就是「受試者」和「實驗者」都不知道施打的是疫苗還是安慰劑,台灣也不例外。既然都不知道自己打了什麼,憑什麼「覺得很好」。
正是因為如此,陳建仁自己隨後也發文澄清,僅讚許實驗過程的嚴謹,對疫苗是否有效隻字未提,等於也間接打臉了帶風向文。
畢竟,二期報告尚未「解盲」前,誰都無法肯定地說疫苗是否安全有效。現在跳出來自稱說知道疫苗有效或沒效的,都可能在傷害雙盲試驗的嚴謹性。
要弄清楚國產疫苗的安全性和有效性,方法只有一個,就是依循研發程序,等候第二期解盲分析的報告,以及第三期的期中報告。
第三,既然國產疫苗的報告都沒看到,EUA也沒通過,為什麼政府急著簽約採購?
答案是,政府目前的辯解都很有問題,但各種缺乏證據的質疑聲浪,對於釐清事實與責任根本毫無幫助。
先說事實,5月28日,政府簽約訂購1千萬劑國產疫苗的那一刻,是處於「安全性和有效性不明,也尚未通過EUA」的狀態,而這個狀態至今沒有改變。
可以想見,前面提到的一堆帶風向,就是為了掩飾這個狀態,所以各種過度吹捧,想要藉此壓制質疑的聲浪。然而,目前各種基於科學事實的質疑,已經使得指揮中心也承認,國產疫苗如果二期解盲失敗或沒拿到EUA,就不能採購施打。
緊接著的下一個關鍵問題是,既然明知效果不明,政府為什麼硬要搶先「預採購」呢?或者退一萬步言,就算國產疫苗真的如大家說得好,也即將在6月中解盲,政府那為什麼非要在5月28日先簽約,不能再等個兩週看過報告後再說呢?
有特定政黨和人士搶著批評,政府官員是為了炒股,所以要護航國產疫苗,但這種質疑至今缺乏證據檢驗,除了引起更多罵戰,其實對於釐清問題毫無幫助。
目前看來最有可能的解釋,是這波本土疫情來得太快太猛,讓政府措手不及,原本預計可以更從容取得國產疫苗的規劃期程也被打亂,但又不願意承認自己掉以輕心,為了轉移民間要求儘速進口國外疫苗的壓力,只好出此下策。
之所以說是下策,是因為要承擔太多不確定性,以及確定已付出了許多原本不必要的成本。
不確定的是,明明二期還沒解盲,三期還沒開始做,如果屆時疫苗的安全性和有效性不如預期,政府該拿什麼捍衛國人的健康?到時候防疫成效和政治誠信兩頭空,又有誰能負責?
確定的是,這種不合程序的做法,姑且不論那些趁火打劫的罵聲,光是許多專家提出的質疑,就夠讓政府無法招架了。
我們就假定,二期解盲順利成功,接下來的EUA仍然立刻會出現兩種具體質疑。第一,政府先採購了一千萬劑,不就給EUA審查「先射箭再畫靶」的無形壓力嗎?第二,在這種壓力下,如果做出「根本還沒進行第三期,就可以取得EUA」這樣的審查結果,能夠從科學上保證疫苗的有效性與安全性嗎?
老實說,比起「政府護航國產疫苗」,或許「政府正在陷國產疫苗於不義」的描述會更為貼切。
設想一下,明明是一個可以靠著實力申請進入理想學校的學生,學校卻搶在申請和審查之前,以「早知道他是人才」為由搶先發給他校服和入學須知,即便未來順利入學,也注定要被貼上「走後門」的特權標籤。
最後,回顧政府最近有關疫苗的政策,其實已經出現不少大轉彎,從「只有政府洽談才能確保疫苗安全」到「公私協力儘速取得,政府後續把關」,從「自費施打不得自選疫苗」到「開放自選疫苗」,都表示政府確實第一時間沒有做好,但之後也都有改進的空間。
同樣的,絕大多數的國人都希望國產疫苗成功,但科學要求和國際標準訂在那邊並不是訂好玩的,即便人命關天要EUA,也都有一定的要件要遵循,才能減少爭議,更能確保疫苗的安全性與有效性。
要解決疫苗爭議,最好的方式是回歸科學證據,既然國外疫苗都是「做完二期,正在做三期擴大試驗並提供期中報告」才拿到EUA,那國產疫苗就不該例外,絕對不要因為政府「預採購」,就硬著頭皮跳過應有程序通過EUA。
民眾的疫苗焦慮是真實的,來自科學界的專業質疑也是真實的,國共趁火打劫,拿台灣最不想接受的中國疫苗來操作,也是真實的。政府一邊不把話講完整,一邊放任民代和粉專講一堆吹捧過頭的幹話,再等著被大家用專業說法打臉,這不是舉球手,什麼是舉球手?
公私協力儘速取得疫苗,同時讓國產疫苗在遵循應有程序取得EUA,並誠懇向國人說明疫苗取得的正確時程,以及儘速提出疫苗施打計畫,屆時用最快速度讓民眾施打,才是避免做好防疫,化解民怨,防止被趁火打劫的正確做法。
●作者:李兆立/政治工作者
●本文為作者評論意見,不代表《NOWnews今日新聞》立場
●《今日廣場》歡迎來稿或參與討論,請附真實姓名及聯絡電話,文章歡迎寄至:opinion@nownews.com