中央流行疫情指揮中心5月28日與國產疫苗廠高端及聯亞簽署採購合約,表示將在兩家疫苗解盲,並取得緊急授權後,各採購500萬劑,總計1000萬劑。若計入開口合約,最高可採購2000萬劑。
這個消息傳出,立刻引起社會大眾的關注,也有不少醫界及生技界的人士,對於指揮中心採購二期臨床試驗還沒結束的疫苗,表示憂心及憤怒。那麼,到底臨床試驗為什麼要分成一、二、三期,甚至還有第四期?
簡單來說,不管是疫苗也好、藥物也罷,在研發的初期通常都是進行藥物的研究以及動物毒理試驗等在實驗室進行的工作,因此,除了藥廠會獨力研發外,也可能會委託研究機構或學術研究單位進行。
隨著藥物開發到了一定階段,就必須進入臨床試驗的環節。一般說來,新藥物的臨床試驗通常分成一至四期,其中一至三期是上市前申請「新藥查驗登記」(New drug application, NDA)所需,也就是說,新藥品在上市前,是「必須」經過並完成三期臨床試驗的。
關於臨床試驗分期
一般來說,第一期臨床試驗(PHASE I)的目的,在於觀察藥物對人體之安全性與藥理作用,目的在於確定藥品的安全性及劑量。在這個階段,一般測試對象大概20到50人。
到了第二期臨床試驗(PHASE II),測試的對象就會擴大為50至300人左右,主要測試目的在於評估不同的劑量,對病患的有效性及安全性。為了試驗的可信度,利用統計科學來嚴謹評估其臨床療效與安全性。參與臨床試驗的病人分為對照組與試驗組;試驗組給予研究之新藥,而對照組為已上市之藥物作比較,視情況亦可服用無藥效之佐劑當對照(安慰劑)組。
在經過一期及二期臨床後,基本上可以確定藥物的安全性及劑量後,才開始第三期臨床試驗,用以驗證藥物的藥效或疫苗的整體保護力與重症保護力。換句話說,一直到第三期臨床試驗前,藥物及疫苗的藥效,基本上都沒有科學且客觀的數據。
臨床不過關 藥物開發喊停
若是到了臨床試驗階段,才發現藥物效果不盡理想,那麼藥物開發會喊停嗎?答案是:會。
輝瑞藥廠曾經研發一款名為昔多芬(Sildenafil),主效是治療心血管疾病的藥品,後來在臨床試驗中,因為藥效未達預期,而於1991年4月喊停。
但後來卻發現昔多芬的副作用對受試者的性生活有所助益,於是研究轉向,最終於1998年3月獲得美國FDA的上市許可,上市時的藥品名也改成了「威而鋼(Viagra)」。

▲WHO批准緊急授權疫苗比較(圖/NOWnews自製圖)
關於緊急授權(EUA)
但是,以新冠疫苗的研發來說,由於疫情來勢洶洶,疫苗的研發進度在疫情嚴峻的情況下,就必須在「不影響藥品安全性及有效性」的前提下,盡量簡化、加速相關的藥品申請核准的流程。
以美國食品及藥物監督管理局(FDA;Food and Drug Administration)申請緊急使用授權(EUA;Emergency Use Authorization)的流程來看,所有的疫苗都必須完成一期及二期臨床試驗,且必須完成三期臨床試驗的期中數據分析後,才能向FDA申請EUA。
以FDA的規定,疫苗要申請EUA,則三期臨床試驗必須追蹤3個月的數據,以了解疫苗保護力的持續時間,以及過程中是否會發生罕見的不良事件。
以最近成為話題焦點的輝瑞BNT疫苗來看,這支疫苗自2020年1月開始開發,2020年4月,分別在美國及德國進行一期及二期的臨床試驗,同年8月在學術期刊《自然》發表了一、二期的結果。
2020年7月,輝瑞與BioNTech展開了第三期臨床試驗,到同年10月測試採集統計數據截止,試驗規模多達4萬餘人。11月18日輝瑞發表三期臨床試驗的期中報告,並向FDA申請EUA。
美國FDA則是於2020年12月2日批准該疫苗的緊急使用授權,接下來,也是從12月開始,才大規模在以色列進行疫苗施打。
國產疫苗的爭議
2020年12月30日,高端疫苗宣布已獲衛福部許可,開始第二期臨床試驗,預計於6月30日才完成二期臨床試驗,5月28日衛福部與高端及聯亞簽訂採購合約時,這兩家疫苗廠的二期臨床試驗都還沒有完成,立刻引發爭議。
5月31日中央流行疫情指揮中心指揮官陳時中強調,高端及聯亞的二期臨床試驗規模較國際疫苗為大,且國際性疫苗也都是在三期臨床試驗尚未結束之前,就申請了EUA,衛福部確信兩家疫苗的安全性。
根據指揮中心提供的資料,BNT疫苗的三期臨床試驗預計於2023年4月才會完成,但BNT疫苗早在2020年10月,就完成了三期臨床試驗的統計數據採集,11月就完成了正式的三期期中報告。其他像是AZ、莫德納、嬌生等國際大廠的疫苗也都有做三期臨床試驗,且這些疫苗大廠都拿著三期臨床試驗的期中報告向世界不同的衛生單位,申請疫苗的緊急使用授權。
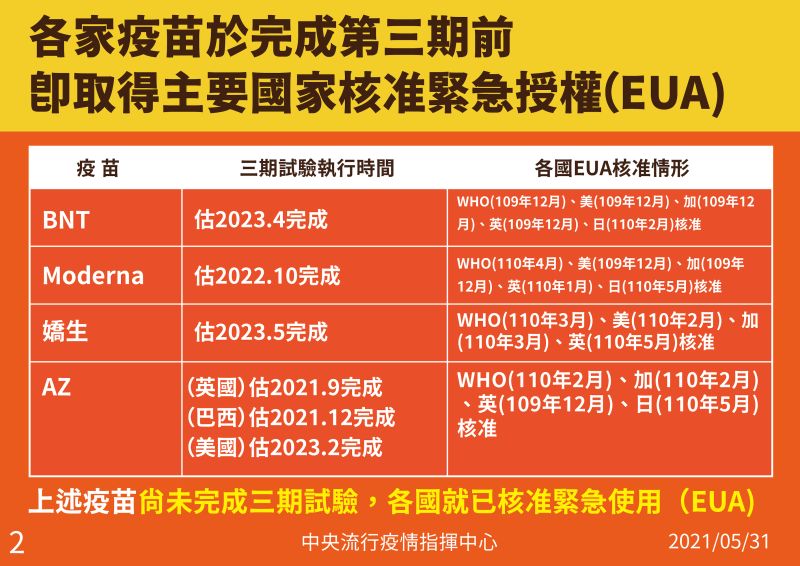
▲各場疫苗完成緊急授權日期。(圖/指揮中心提供)
國產疫苗的美國技術?
包括BNT、莫德納兩支國際大廠的新冠疫苗,採用的是mRNA技術,高端疫苗發展的起源,也是自美國國衛院(NIH)取得了疫苗抗原,並在這個基礎上開發新冠疫苗。
不過,同樣採用mRNA技術的BNT疫苗在開發時,一共有4種候選疫苗,分別為BNT162a1、BNT162b1、BNT162b2及BNT162c2各有不同組合形式的mRNA及目標抗原,輝瑞與BioNTech一直到2020年7月,才選定了BNT162b2為疫苗的成分。意即採用mRNA技術,並不是疫苗必定有效的標準。
從美國FDA的緊急使用授權流程來看,疫苗想要申請緊急使用授權,藥廠就必須進行第三期臨床試驗,且在至少2至3個月的試驗結束後,要能夠拿出該疫苗完成的期中報告,且疫苗的整體保護力(也就是施打後不會生病)必須高過50%,重症保護力(施打後,即使感染也不會轉成重症)則是愈高愈好。
但不管是高端或聯亞,兩款國產疫苗到目前為止二期臨床都還沒有結束,就算可以確信其安全性,但其藥效及疫苗保護力,在進行三期臨床試驗,並完成期中報告之前,都還是未知數。
我是廣告 請繼續往下閱讀
簡單來說,不管是疫苗也好、藥物也罷,在研發的初期通常都是進行藥物的研究以及動物毒理試驗等在實驗室進行的工作,因此,除了藥廠會獨力研發外,也可能會委託研究機構或學術研究單位進行。
隨著藥物開發到了一定階段,就必須進入臨床試驗的環節。一般說來,新藥物的臨床試驗通常分成一至四期,其中一至三期是上市前申請「新藥查驗登記」(New drug application, NDA)所需,也就是說,新藥品在上市前,是「必須」經過並完成三期臨床試驗的。
關於臨床試驗分期
一般來說,第一期臨床試驗(PHASE I)的目的,在於觀察藥物對人體之安全性與藥理作用,目的在於確定藥品的安全性及劑量。在這個階段,一般測試對象大概20到50人。
到了第二期臨床試驗(PHASE II),測試的對象就會擴大為50至300人左右,主要測試目的在於評估不同的劑量,對病患的有效性及安全性。為了試驗的可信度,利用統計科學來嚴謹評估其臨床療效與安全性。參與臨床試驗的病人分為對照組與試驗組;試驗組給予研究之新藥,而對照組為已上市之藥物作比較,視情況亦可服用無藥效之佐劑當對照(安慰劑)組。
在經過一期及二期臨床後,基本上可以確定藥物的安全性及劑量後,才開始第三期臨床試驗,用以驗證藥物的藥效或疫苗的整體保護力與重症保護力。換句話說,一直到第三期臨床試驗前,藥物及疫苗的藥效,基本上都沒有科學且客觀的數據。
臨床不過關 藥物開發喊停
若是到了臨床試驗階段,才發現藥物效果不盡理想,那麼藥物開發會喊停嗎?答案是:會。
輝瑞藥廠曾經研發一款名為昔多芬(Sildenafil),主效是治療心血管疾病的藥品,後來在臨床試驗中,因為藥效未達預期,而於1991年4月喊停。
但後來卻發現昔多芬的副作用對受試者的性生活有所助益,於是研究轉向,最終於1998年3月獲得美國FDA的上市許可,上市時的藥品名也改成了「威而鋼(Viagra)」。

關於緊急授權(EUA)
但是,以新冠疫苗的研發來說,由於疫情來勢洶洶,疫苗的研發進度在疫情嚴峻的情況下,就必須在「不影響藥品安全性及有效性」的前提下,盡量簡化、加速相關的藥品申請核准的流程。
以美國食品及藥物監督管理局(FDA;Food and Drug Administration)申請緊急使用授權(EUA;Emergency Use Authorization)的流程來看,所有的疫苗都必須完成一期及二期臨床試驗,且必須完成三期臨床試驗的期中數據分析後,才能向FDA申請EUA。
以FDA的規定,疫苗要申請EUA,則三期臨床試驗必須追蹤3個月的數據,以了解疫苗保護力的持續時間,以及過程中是否會發生罕見的不良事件。
以最近成為話題焦點的輝瑞BNT疫苗來看,這支疫苗自2020年1月開始開發,2020年4月,分別在美國及德國進行一期及二期的臨床試驗,同年8月在學術期刊《自然》發表了一、二期的結果。
2020年7月,輝瑞與BioNTech展開了第三期臨床試驗,到同年10月測試採集統計數據截止,試驗規模多達4萬餘人。11月18日輝瑞發表三期臨床試驗的期中報告,並向FDA申請EUA。
美國FDA則是於2020年12月2日批准該疫苗的緊急使用授權,接下來,也是從12月開始,才大規模在以色列進行疫苗施打。
國產疫苗的爭議
2020年12月30日,高端疫苗宣布已獲衛福部許可,開始第二期臨床試驗,預計於6月30日才完成二期臨床試驗,5月28日衛福部與高端及聯亞簽訂採購合約時,這兩家疫苗廠的二期臨床試驗都還沒有完成,立刻引發爭議。
5月31日中央流行疫情指揮中心指揮官陳時中強調,高端及聯亞的二期臨床試驗規模較國際疫苗為大,且國際性疫苗也都是在三期臨床試驗尚未結束之前,就申請了EUA,衛福部確信兩家疫苗的安全性。
根據指揮中心提供的資料,BNT疫苗的三期臨床試驗預計於2023年4月才會完成,但BNT疫苗早在2020年10月,就完成了三期臨床試驗的統計數據採集,11月就完成了正式的三期期中報告。其他像是AZ、莫德納、嬌生等國際大廠的疫苗也都有做三期臨床試驗,且這些疫苗大廠都拿著三期臨床試驗的期中報告向世界不同的衛生單位,申請疫苗的緊急使用授權。

國產疫苗的美國技術?
包括BNT、莫德納兩支國際大廠的新冠疫苗,採用的是mRNA技術,高端疫苗發展的起源,也是自美國國衛院(NIH)取得了疫苗抗原,並在這個基礎上開發新冠疫苗。
不過,同樣採用mRNA技術的BNT疫苗在開發時,一共有4種候選疫苗,分別為BNT162a1、BNT162b1、BNT162b2及BNT162c2各有不同組合形式的mRNA及目標抗原,輝瑞與BioNTech一直到2020年7月,才選定了BNT162b2為疫苗的成分。意即採用mRNA技術,並不是疫苗必定有效的標準。
從美國FDA的緊急使用授權流程來看,疫苗想要申請緊急使用授權,藥廠就必須進行第三期臨床試驗,且在至少2至3個月的試驗結束後,要能夠拿出該疫苗完成的期中報告,且疫苗的整體保護力(也就是施打後不會生病)必須高過50%,重症保護力(施打後,即使感染也不會轉成重症)則是愈高愈好。
但不管是高端或聯亞,兩款國產疫苗到目前為止二期臨床都還沒有結束,就算可以確信其安全性,但其藥效及疫苗保護力,在進行三期臨床試驗,並完成期中報告之前,都還是未知數。