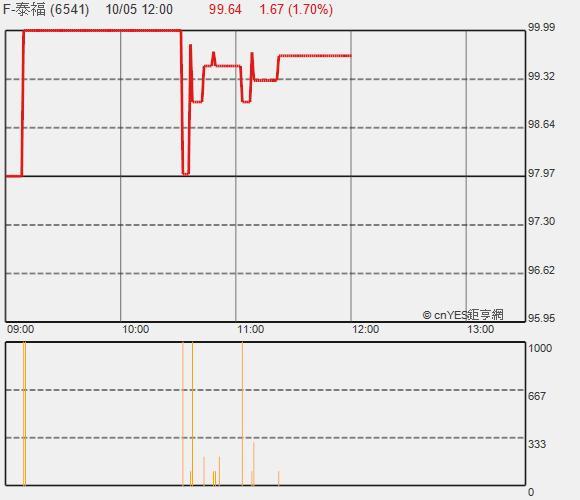
生技廠泰福 - KY(6541-TW) 董事會決議,在不超過 6000 萬美元 (約新台幣 18 億元) 內,進行重組蛋白生物相似藥 TX05(Herceptin Biosimilar) 人體第三期臨床試驗計畫。
泰福 - KY 表示,生物相似藥 TX05 第三期臨床試驗計畫授權台灣泰福董事長趙宇天全權處理 CRO 公司洽談委託臨床試驗計畫、與 CRO 公司議價、簽訂合約及相關文件並處理後續一切相關事宜。
泰福 - KY 表示,此項臨床試驗之受試人數約 800 人,受試對象為被診斷出 HER2(第二型人類表皮生長因子接受體) 陽性成年女性早期乳癌患者。此項試驗將分別在歐洲,亞洲及南美洲等地,約 209 個臨床試驗中心進行此項全球性三期臨床試驗,預計 2020 年完成。
TX05 人體第三期臨床試驗採隨機、雙盲、平行設計,以比較 TX05 與經美國 FDA 核准之原廠參考藥物 Herceptin(原廠藥物開發商: Roche) 其有效性,安全性及免疫原性。
更多精彩內容請至 《鉅亨網》 連結>>
我是廣告 請繼續往下閱讀
泰福 - KY 表示,此項臨床試驗之受試人數約 800 人,受試對象為被診斷出 HER2(第二型人類表皮生長因子接受體) 陽性成年女性早期乳癌患者。此項試驗將分別在歐洲,亞洲及南美洲等地,約 209 個臨床試驗中心進行此項全球性三期臨床試驗,預計 2020 年完成。
TX05 人體第三期臨床試驗採隨機、雙盲、平行設計,以比較 TX05 與經美國 FDA 核准之原廠參考藥物 Herceptin(原廠藥物開發商: Roche) 其有效性,安全性及免疫原性。

更多精彩內容請至 《鉅亨網》 連結>>